- Testes da Atividade dos Fatores de Coagulação:
Pelo menos cinco testes laboratoriais devem ser inicialmente realizados em pacientes com suspeita de doenças hemorrágicas: tempo de tromboplastina parcial ativada (TTPA), tempo de protrombina (TP), tempo de sangria (TS), tempo de trombina (TT) e contagem de plaquetas. Os dois primeiros testes avaliam a fase plasmática da coagulação e os dois últimos a fase celular (plaquetária).
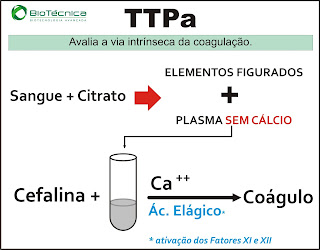
O TTPA mede o tempo de ocorrência da coagulação após a adição de fosfolipídios e cálcio ao plasma, sendo seu valor de referência de cerca de 30 segundos. O TTPA presta-se a avaliar a integridade das vias intrínseca e comum da coagulação, isto é, dos fatores V, VIII, IX, X, XI, XII, protrombina, fibrinogênio, pré-calicreína e cininogênio de alto peso molecular.
O TP mede o tempo de ocorrência da coagulação, após a adição de tromboplastina tecidual e cálcio ao plasma. Seu valor de referência pode ser expresso em tempo (em torno de 14 segundos) ou em percentual (70-100%). Devido à ampla variabilidade na potência das tromboplastinas utilizadas, o TP deve ser expresso em RNI, quando utilizado para o controle de anticoagulação oral. O TP presta-se a avaliar a integridade das vias extrínseca e comum, isto é, dos fatores V, VII, X, protrombina e fibrinogênio.
O prolongamento do TTPA ou TP indica:
a) deficiência de um ou mais fatores da coagulação;
b) anticorpo circulante (inibidor), que pode ser direcionado a um dos fatores da coagulação;
c) lúpus anticoagulante.
Um teste fácil e rápido, denominado teste de mistura, é capaz de diferenciar entre essas duas condições. Neste caso, o TP e TTPA são realizados com 50% do plasma do paciente e 50% do plasma normal. A normalização do teste sugere deficiência e não normalização de inibidor. Esse teste deve ser realizado pelo laboratório sempre que houver prolongamento do TTPA ou TP. Mediante a suspeita de inibidor, o teste deve também ser realizado após incubação a 37ºC por duas horas, uma vez que alguns inibidores (em especial os inibidores direcionados contra o F VIII) são tempo e temperatura dependentes. O TS mede a integridade da função plaquetária e da parede vascular. A técnica recomendada é a de Ivy (valor de referência entre 1-9 minutos), que mede o tempo de cessação do sangramento após pequena incisão realizada na face anterior do antebraço. Para tal, deve-se empregar um dispositivo próprio, descartável, que produz uma incisão de comprimento, largura e profundidade padronizados. O TS pela técnica de Duke, que mede o tempo de sangramento após punção da ponta do dedo ou lóbulo de orelha por agulha, não é de valor clínico e não deve ser utilizado. O TS encontra-se prolongado em doenças plaquetárias qualitativas, quantitativas (plaquetopenias), doenças vasculares primárias (p. ex., vasculites) e doenças resultantes de defeitos de interação entre plaquetas e a parede dos vasos que alteram a adesão plaquetária (p. ex. doença von Willebrand, DVW).
 O TS pode prolongar-se após o uso de AAS e AINES, devendo-se adiar a realização do exame por pelo menos duas semanas após o uso desses medicamentos. O TS não se encontra prolongado em pacientes com deficiências dos fatores da coagulação. Recentemente, o TS pela técnica de Ivy vem sendo substituído pelo equipamento PFA (da sigla em inglês, platelet function analyser). Esse equipamento vem sendo cada dia mais utilizado para auxiliar os diagnósticos de doenças plaquetárias e DVW. O TT avalia o tempo de coagulação do plasma citratado na presença de trombina, permitindo testar a conversão de fibrinogênio a fibrina. Esse teste avalia diretamente o fibrinogênio funcional, sendo utilizado para investigar defeitos na molécula do fibrinogênio. Está prolongado na existência de heparina, em altas concentrações de imunoglobulinas (por exemplo, na macroglobulinemia de Waldenstrom), nas disfibrinogenemias, na hipofibrinogenemia, sendo incoagulável na afibrinogenemia. O TT é um bom teste para triagem de PDF, presente na CIVD e na fibrinólise. Nesse caso, um teste da mistura para TT sem correção possivelmente decorre da presença de PDF. Há vários anos a contagem de plaquetas vem sendo realizada rotineiramente por equipamento de contagem eletrônica de células. Porém, na vigência de plaquetopenia (plaquetas < 150.000/ mm3 ), deve-se sempre proceder à contagem manual de plaquetas, preferencialmente pela contagem na câmara de Newbauer. Adicionalmente, a realização de hematoscopia é importante, uma vez que permite a visibilização do esfregaço de sangue por intermédio do microscópio, auxiliando o diagnóstico de várias condições, tais como pseudoplaquetopenia, doenças plaquetárias qualitativas, púrpura trombocitopênica trombótica (PTT), entre outras. Algumas doenças da hemostasia, tais como deficiência de F XIII, DVW, deficiências leves de fatores da coagulação e deficiências de fatores da via da fibrinólise, podem não apresentar qualquer anormalidade dos quatro testes de triagem descritos. Nesses casos, o paciente deve ser submetido a outros tipos de exames e/ou ser encaminhado para avaliação especializada. Outras vezes, pode haver alteração importante dos testes de coagulação, sem haver, contudo, história hemorrágica. Este é o caso das deficiências de pré-calicreína, F XII e cininogênio de alto peso molecular, que podem cursar com prolongamento significativo do TTPA sem, contudo, manifestação clínica de sangramento. Pacientes com lúpus anticoagulante, apesar de terem TTPA prolongado, não exibem hemorragias, mas tendência à trombose venosa e/ou arterial. Pacientes com deficiência de F VII e F XI podem possuir TP prolongado, somente revelado em exame pré-operatório ou periódico, sem história prévia de hemorragia.
O TS pode prolongar-se após o uso de AAS e AINES, devendo-se adiar a realização do exame por pelo menos duas semanas após o uso desses medicamentos. O TS não se encontra prolongado em pacientes com deficiências dos fatores da coagulação. Recentemente, o TS pela técnica de Ivy vem sendo substituído pelo equipamento PFA (da sigla em inglês, platelet function analyser). Esse equipamento vem sendo cada dia mais utilizado para auxiliar os diagnósticos de doenças plaquetárias e DVW. O TT avalia o tempo de coagulação do plasma citratado na presença de trombina, permitindo testar a conversão de fibrinogênio a fibrina. Esse teste avalia diretamente o fibrinogênio funcional, sendo utilizado para investigar defeitos na molécula do fibrinogênio. Está prolongado na existência de heparina, em altas concentrações de imunoglobulinas (por exemplo, na macroglobulinemia de Waldenstrom), nas disfibrinogenemias, na hipofibrinogenemia, sendo incoagulável na afibrinogenemia. O TT é um bom teste para triagem de PDF, presente na CIVD e na fibrinólise. Nesse caso, um teste da mistura para TT sem correção possivelmente decorre da presença de PDF. Há vários anos a contagem de plaquetas vem sendo realizada rotineiramente por equipamento de contagem eletrônica de células. Porém, na vigência de plaquetopenia (plaquetas < 150.000/ mm3 ), deve-se sempre proceder à contagem manual de plaquetas, preferencialmente pela contagem na câmara de Newbauer. Adicionalmente, a realização de hematoscopia é importante, uma vez que permite a visibilização do esfregaço de sangue por intermédio do microscópio, auxiliando o diagnóstico de várias condições, tais como pseudoplaquetopenia, doenças plaquetárias qualitativas, púrpura trombocitopênica trombótica (PTT), entre outras. Algumas doenças da hemostasia, tais como deficiência de F XIII, DVW, deficiências leves de fatores da coagulação e deficiências de fatores da via da fibrinólise, podem não apresentar qualquer anormalidade dos quatro testes de triagem descritos. Nesses casos, o paciente deve ser submetido a outros tipos de exames e/ou ser encaminhado para avaliação especializada. Outras vezes, pode haver alteração importante dos testes de coagulação, sem haver, contudo, história hemorrágica. Este é o caso das deficiências de pré-calicreína, F XII e cininogênio de alto peso molecular, que podem cursar com prolongamento significativo do TTPA sem, contudo, manifestação clínica de sangramento. Pacientes com lúpus anticoagulante, apesar de terem TTPA prolongado, não exibem hemorragias, mas tendência à trombose venosa e/ou arterial. Pacientes com deficiência de F VII e F XI podem possuir TP prolongado, somente revelado em exame pré-operatório ou periódico, sem história prévia de hemorragia.- Distúbios de Hemostasia:
Hemofilia B:
Deficiência do fator IX (doenças de Christmas) de caráter hereditário recessivo e ligado ao sexo deve ser distinguida da hemofilia A pela determinação específica do fator deficiente. O número de afetados é aproximadamente seis vezes menor do que para a hemofilia A. Em situações em que exista risco de
sangramento, os cuidados devem ser semelhantes aos da hemofilia clássica Doença de von Willebrand. Deficiência do fator de Von Willebrand (VIII:vW) de caráter hereditário dominante e autossômico afeta tanto a hemostasia primária — pois funciona como mediador da adesividade plaquetária quanto a secundária, que regula a produção ou liberação do fator VIII:C que participa da via intrínseca. A administração de plasma fresco ou crioprecipitado produz elevação imediata do fator VIII:vW, que corrige o tempo de sangramento durante duas a seis horas, enquanto o pico para o fator VIII:C ocorre 48 horas após. Estes dados justificam a recomendação de iniciar a reposição um dia antes do procedimento cirúrgico (correção da hemostasia secundária) e imediatamente antes do início da cirurgia (correção da hemostasia primária).
Deficiência de Vitamina K:
A vitamina K é essencial na formação de várias proteínas da coagulação. Os fatores vitamina K-dependentes são: II, VII, IX e X, portanto um problema relacionado com a vitamina K afeta os três sistemas. Esses fatores são sintetizados em uma forma afuncional (acarboxiladas) e sofrem uma reação de carboxilação em que a vitamina K participa como cofator, produzindo centro de ligação para o cálcio, necessário para sua função normal. Durante esta reação a vitamina K é convertida num metabólito inativo (vitamina K-epóxido). A enzima epóxido-redutase é responsável pela reciclagem deste metabólito, convertendo-o para a forma ativa, razão pela qual a necessidade diária de vitamina K é pequena. Dentre as principais causas de problemas hemostáticos relacionados com a vitamina K estão: ƒ
Ingestão de rodenticidas anticoagulantes que levam à inibição desta enzima, e à rápida depleção dos estoques de vitamina K do organismo (ex: warfarina e cumarínicos). ƒ
- Deficiência de sais biliares no intestino: impede a absorção da vitamina K que é lipossolúvel. ƒ
- Doença hepática pode resultar na falta de utilização da vitamina.
- O diagnóstico laboratorial típico inclui TP: prolongado e TTPa: prolongado.
Doença hepática:
O fígado é o local de síntese de proteínas da coagulação (fatores protéicos). Problemas de coagulação causados por doença hepática só acontecem em casos severos, nestes casos todos os sistemas da coagulação são afetados, pois todos os sistemas possuem fatores produzidos pelo fígado. Cerca de 50% dos gatos com lipidose hepática podem apresentar problema. O diagnóstico da doença hepática deve ser feito com uma boa avaliação clínico-laboratorial e previamente aos testes de coagulação deve-se utilizar os testes lesão e função hepática, biópsia e punção por agulha fina, diagnóstico por imagem, etc. Devido a meia vida do fator VII ser curta, a determinação da atividade deste fator é utilizada como auxílio diagnóstico de doença hepática aguda ou crônica. O diagnóstico laboratorial pode incluir TP: prolongado e TTPa: prolongado.
Outros fatores:
- Deficiência de fator VII - sistema extrínseco: Afeta várias raças de cães, principalmente os Beagles. No diagnóstico observa-se TP: prolongado e TTPa: normal.
- Deficiência de fator XII - sistema intrínseco: as principais raças de cães afetadas são: poodle, pointer alemão e sharpei. Também afeta gatos. Diagnóstico com TP: normal e TTPa: prolongado.
- Deficiência de fator XI - sistema intrínseco: Afeta cães e cabras. Diagnóstico com TP: normal e TTPa: prolongado.
- Deficiência de fator X - Sistema comum: Afeta Cocker Spaniel e Jack Russel Terrier. Diagnóstico com TP: prolongado e TTPa: prolongado.
Referências:
HEMOSTASIA E DISTÚRBIOS DA COAGULAÇÃO Daniel Cagnolati1 Ajith Kumar Sankarankutty, João Plínio Souza Rocha, André Beer, Orlando Castro e Silva1, Faculdade de Medicina de Ribeirão Preto -USP- Ribeirão Preto-SP 2 Faculdade de Medicina da USP.
Portal Educação, Google Analytics. Disponível em:http://www.portaleducacao.com.br/farmacia/artigos/25511/hemostasia-o-que-e> Acessado em 03 de novembro de 2015
Info escola, disponível em :http://www.infoescola.com/sistema-circulatorio/hemostasia/ Acessado em 03 de novembro de 2015
FISIOLOGIA DA COAGULAÇÃO, ANTICOAGULAÇÃO E FIBRINÓLISE FRANCO RF. Fisiologia da coagulação, anticoagulação e fibrinólise. Medicina, Ribeirão Preto, 34: 229-237, jul./dez. 2001.
Manual de patologia clinica- UFSM( universidade federal de santa maria)-CCR(centro de ciências rurais)-Departamento de clinica de pequenos animais